以下是CRISPR技术存在的主要风险,进行详细梳理:
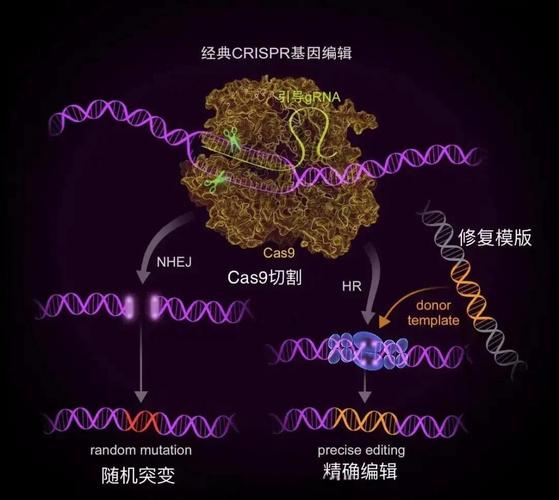
技术层面上的风险(脱靶效应与不可预测性)
这是CRISPR技术最核心、最直接的技术风险,也是目前科研领域重点攻关的方向。
-
脱靶效应
- 描述:CRISPR系统(由向导RNA和Cas9蛋白组成)的设计目标是精确切割DNA上特定的序列,由于向导RNA可能与基因组中其他与目标序列相似的“非目标”位点部分匹配,导致Cas9蛋白错误地切割了这些地方,这就像一个精准的导弹,却意外地击中了错误的建筑。
- 后果:
- 致癌风险:如果错误地切断了抑癌基因或激活了原癌基因,可能会引发细胞癌变,这是体细胞基因治疗和生殖系编辑中最令人担忧的风险之一。
- 未知功能破坏:人类基因组中大量DNA的功能尚不明确,脱靶切割可能会破坏这些区域的调控元件,导致未知的、长期的生物学后果。
- 现状:虽然科学家们已经开发出了更精确的Cas9变体(如高保真Cas9)和改进的向导RNA设计算法来降低脱靶率,但完全消除脱靶效应仍然是一个巨大的挑战。
-
脱靶效应之外的“在靶”但非预期效应
- 描述:即使CRISPR在完全正确的目标位点进行了切割,修复过程也可能出错。
- 后果:
- 大片段缺失或重排:细胞在修复DNA双链断裂时,除了通过“非同源末端连接”途径进行简单的修复外,还可能发生大片段的DNA丢失、倒位或染色体易位,这比单个碱基的突变要严重得多,可能导致基因功能完全丧失或产生新的、有害的融合蛋白。
- 嵌合体问题:在编辑早期胚胎或大量细胞群体时,并非所有的细胞都会被成功编辑,结果可能是一个个体或组织由经过编辑的细胞和未经编辑的细胞混合而成,即“嵌合体”,这会导致表型不可预测,治疗效果大打折扣。
-
编辑效率的不确定性
 (图片来源网络,侵删)
(图片来源网络,侵删)- 描述:在不同类型的细胞、不同的组织环境中,CRISPR的编辑效率差异很大,有些细胞可能对编辑工具“免疫”,导致编辑失败。
- 后果:在治疗应用中,如果只有一小部分目标细胞被成功编辑,治疗效果可能微乎其微,甚至无效。
应用层面上的风险(体细胞 vs. 生殖系编辑)
CRISPR的应用场景不同,其风险等级也截然不同。
体细胞基因编辑
这是指对个体身体内的细胞(如血细胞、肝细胞)进行基因编辑, changes are not passed on to future generations.
- 风险:
- 技术风险放大:上述脱靶、在靶非预期效应等风险直接作用于患者,如果发生,后果全部由该个体承担。
- 长期安全性未知:基因编辑的细胞在体内存活多久?其长期影响如何?我们可能需要数年甚至数十年的追踪研究才能确定。
- 免疫反应:Cas9蛋白来源于细菌,人体免疫系统可能将其识别为外来入侵者,引发强烈的免疫反应,不仅会清除编辑过的细胞,还可能对造成严重的健康损害。
- 例子:治疗镰状细胞贫血、囊性纤维化、某些癌症(如CAR-T细胞疗法)。
生殖系基因编辑
这是指对精子、卵子、受精卵或早期胚胎的基因进行编辑, changes are heritable and will be passed on to all future generations.
- 风险(体细胞风险的全部,外加以下致命风险):
- 不可逆的永久性改变:一旦对生殖系细胞进行编辑并成功孕育后代,这个基因改变将永久写入人类的基因库,任何错误都无法撤销,影响将扩散到无数后代身上。
- 对人类基因库的未知影响:我们无法预测一个经过编辑的基因在复杂的遗传网络中,经过几十代传递后会产生怎样的连锁反应,它可能在特定环境下有益,但在其他环境下有害,甚至导致新的遗传疾病。
- “设计婴儿”与社会公平:这是最引人关注的伦理风险,如果技术成熟,可能会被用于“增强”而非“治疗”,例如选择身高、智力、肤色等,这将:
- 加剧社会不公:只有富人才能负担得起这种“基因优化”,导致人类分化为“基因优化”和“自然”两个阶层,形成新的、不可逾越的社会鸿沟。
- 定义“完美”的压力:社会对“正常”和“残疾”的定义会变得极端,给残障人士及其家庭带来巨大压力,并可能导致基因多样性的丧失。
- 法律与监管真空:目前全球绝大多数国家都禁止或严格限制以生殖为目的的人类生殖系基因编辑,缺乏统一的国际监管框架,容易导致“科学狂人”或不负责任的机构在监管薄弱的地区进行实验,带来灾难性后果。
生态系统与环境风险
如果CRISPR技术被用于改造生物体并释放到环境中,可能带来生态灾难。
-
基因驱动
- 描述:这是一种利用CRISPR让某个特定基因(如抗病基因或不育基因)在种群中“超级遗传”的技术,旨在快速消灭或控制整个物种(如传播疟疾的蚊子、入侵物种)。
- 风险:
- 不可控的扩散:基因驱动生物体一旦释放到野外,其基因可能会通过花粉或交配迅速扩散到其他种群,甚至跨越物种界限,造成难以预料的生态连锁反应,试图消灭一种蚊子,可能无意中破坏了以它为食的鸟类和蝙蝠的生存,导致整个食物链崩溃。
- 无法召回:与化学农药不同,基因驱动的生物体一旦在自然界中站稳脚跟,几乎不可能被召回或清除。
-
对生物多样性的威胁
- 描述:如果大规模种植经过基因编辑的作物,可能会影响与其共生的昆虫、微生物等,减少生物多样性。
- 风险:超级杂草或害虫的出现,如果编辑作物与野生近缘物种杂交,可能会将抗除草剂或抗虫的基因转移到野生种群中,创造出难以控制的“超级杂草”或“超级害虫”。
伦理、社会与治理风险
- “滑坡谬误”:一旦我们接受了治疗严重遗传疾病的生殖系编辑,那么治疗“不那么严重”的疾病(如近视、肥胖)的门槛就会降低,最终滑向非治疗性的“基因增强”。
- 知情同意的困境:对于胚胎编辑,未来的个体无法在事前同意这项操作,我们是否有权替他们做出可能影响其一生的决定?
- 责任归属:如果基因编辑的后代出现了健康问题,责任谁来承担?是研发机构、医生、父母,还是整个社会?
- 安全与伦理的双重标准:发达国家和发展中国家在获取和应用这项技术的能力上存在巨大差距,可能导致新的全球性不平等。
CRISPR技术是一把锋利的“双刃剑”。
- 其巨大的潜力在于它为治愈数千种遗传性疾病、攻克癌症、开发新型疗法和改良作物带来了前所未有的希望。
- 其巨大的风险则在于技术上的不完美、对人类基因库的永久性改变、潜在的生态灾难以及深刻的社会伦理挑战。
在推动CRISPR技术研究和应用的同时,必须建立极其严格的监管框架、进行深入的公众对话、并坚守伦理底线,尤其对于生殖系基因编辑,全球科学界和社会应达成广泛共识,在确保其绝对安全和伦理可接受之前,暂停任何以生殖为目的的临床应用,这需要科学家、伦理学家、法律专家、政策制定者和公众的共同努力,确保这项强大的技术能够被负责任地用于造福全人类。